STUDIO DI METALLOPROTEINE ARTIFICIALI BASATE SUL COSTRUTTO SPY |
Tipologia Tesi magistrale |
Disponibile dal 01/09/2023 |
Presso |
Per i corsi di laurea
|
Stato Disponibile |
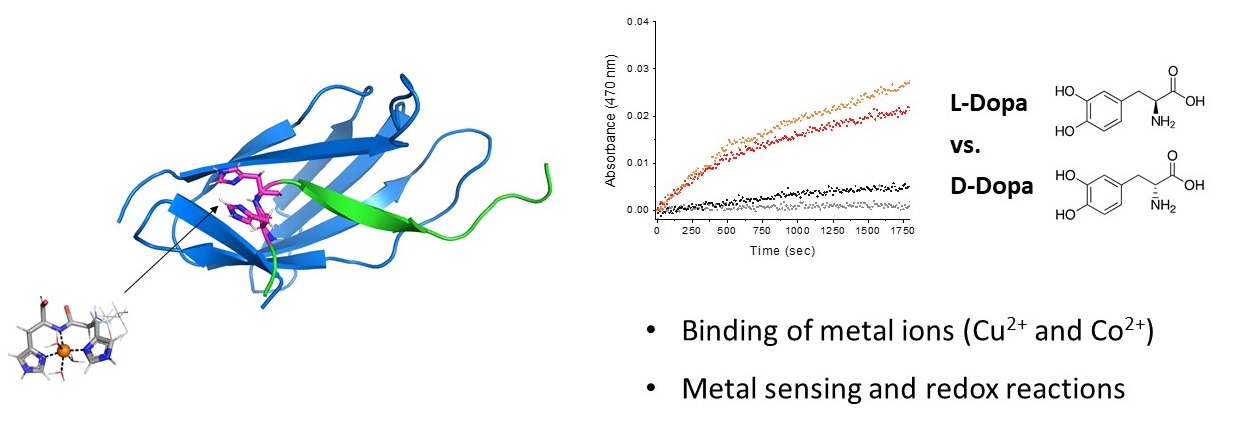
DescrizioneIl progetto di tesi riguarda lo studio del legame di ioni metallici ad una proteina artificiale, e lo studio delle relative proprietà catalitiche redox. Il progetto rientra nel campo del Protein Design. La progettazione di proteine ed in particolare delle metalloproteine è un campo di studio che ha avuto una espansione straordinaria negli ultimi anni in aree quali la synthetic biology, il campo farmaceutico, il campo alimentare e le biotecnologie industriali. Grazie ad avanzati strumenti di calcolo è possibile determinare modelli tridimensionali di proteine, anche attraverso progettazione ab inizio, ossia senza avere alcuna informazione sulla struttura del costrutto proteico stesso. Il progetto di tesi si inserisce in un progetto di ricerca che riguarda lo sviluppo di nuove metalloproteine artificiali utilizzando un costrutto denominato Spy che consta di due componenti, una proteica (Catcher) e una peptidica (Tag) che, reagendo assieme, ricostituiscono una proteina foldata. L’introduzione di siti metallici e di cofattori metallici su questo costrutto potrà permettere l’isolamento di nuove classi di metalloenzimi catalitici in grado di promuovere reazioni chimiche su substrati organici in condizioni green (mezzo acquoso e temperatura ambiente). Durante il periodo di tesi lo studente acquisirà le seguenti competenze: - Preparazione e caratterizzazione spettroscopica di campioni di biomolecole - Studio della interazione fra ioni metallici con peptidi e proteine, sia naturali che di sintesi - Utilizzo delle principali tecniche spettroscopiche: UV-Vis, fluorescenza, dicroismo circolare, NMR - Utilizzo di software per lo studio e la modellizzazione di proteine
|
Rivolgersi a |
Docente Prof. Matteo Tegoni |
Email |
Telefono 0521905424 |